Wodorotlenki – ich budowa i otrzymywanie
Gdy do wody wrzucisz sól lub cukier, po prostu się rozpuszczą – powstanie roztwór, czyli mieszanina jednorodna. Co się stanie, gdy do wody wrzucimy metal lub jego tlenek? Czy w obu przypadkach reakcja będzie taka sama? Co powstanie: mieszanina czy związek chemiczny? W jak sposób możemy to sprawdzić?
„Aktywny” znaczy: czynny, dynamiczny, energiczny, przebojowy. Jaki zatem metal nazywamy „aktywnym”?

wartościowość atomów metali w związkach chemicznych;
sposób tworzenia wiązania jonowego i jego charakterystykę;
sposób zapisu wzorów związków chemicznych, na podstawie znajomości wartościowości atomów pierwiastków tworzących te związki;
metody identyfikacji wodoru wydzielającego się z naczynia reakcyjnego;
sposób zapisu równań reakcji chemicznych.
definiować pojęcia „wodorotlenek” i „zasada”;
zapisywać nazwy wodorotlenków w oparciu o ich wzory i odwrotnie;
wymieniać i opisywać metody otrzymywania wodorotlenków oraz zapisywać odpowiednie równania reakcji;
projektować doświadczenia pozwalające na otrzymanie wodorotlenku w reakcji odpowiedniego metalu lub tlenku metalu z wodą;
podawać przykłady metali i tlenków metali reagujących z wodą;
identyfikować produkty reakcji metali aktywnych z wodą;
podawać przykłady wskaźników kwasowo‑zasadowych oraz określać ich barwę w wodzie i w zasadach.
1. Wodorotlenki – budowa
WodorotlenkiWodorotlenki to związki chemiczne o budowie jonowej, utworzone z kationów metalu () i anionów wodorotlenkowych (). Jony te przyciągają się w wyniku działania sił elektrostatycznych, tworząc sieć krystalicznąsieć krystaliczną. Wodorotlenki nie tworzą zatem cząsteczek i, jak większość związków o opisanej budowie, są substancjami o stałym stanie skupienia oraz odznaczają się wysokimi temperaturami wrzenia i topnienia.
Ponieważ jon wodorotlenkowy ma wartościowość równą , ogólny wzór wodorotlenków możemy zapisać jako:

gdzie: – symbol metalu; – liczba jonów wodorotlenkowych równa wartościowości metalu (pamiętaj, że we wzorach sumarycznych związków chemicznych nie zapisujemy indeksów stechiometrycznych o wartości ).
Nazwy wodorotlenków tworzymy przez dodanie do słowa „wodorotlenek” nazwy metalu tworzącego dany związek (w dopełniaczu) oraz, jeśli jest taka potrzeba, wartościowości metalu. Przykładowo, jeśli pierwiastkiem wchodzącym w skład wodorotlenku jest sód, którego atomy w związkach chemicznych przyjmują wartościowość równą (sód położony jest w grupie układu okresowego), to wzór sumaryczny wodorotlenku ma postać:

a jego nazwa to: wodorotlenek sodu.
W skład sieci krystalicznej wodorotlenku sodu wchodzą kationy sodu () i aniony wodorotlenkowe (). Fragment modelu wspomnianej sieci krystalicznej analizowanego wodorotlenku przedstawia poniższa grafika.

Wartościowość atomów metali i grupy układu okresowego jest w związkach chemicznych zawsze taka sama (atomy metali grupy układu okresowego w związkach chemicznych mają wartościowość równą , a atomy metali grupy układu okresowego wartościowość równą ). Podobna sytuacja ma miejsce dla atomów cynku (wartościowość jego atomów w związkach chemicznych wynosi ) oraz glinu (wartościowość ). Nazwy wodorotlenków wymienionych metali tworzymy analogicznie do nazwy wodorotlenku sodu – bez podawania wartościowości metalu. W przypadku wodorotlenków pozostałych metali, do nazwy wodorotlenku dodaje się w nawiasie cyfrę rzymską, która określa wartościowość atomów metalu w rozpatrywanym związku chemicznym.
Przykładowo żelazo może tworzyć wodorotlenek, w którym wartościowość atomów metalu równa jest :
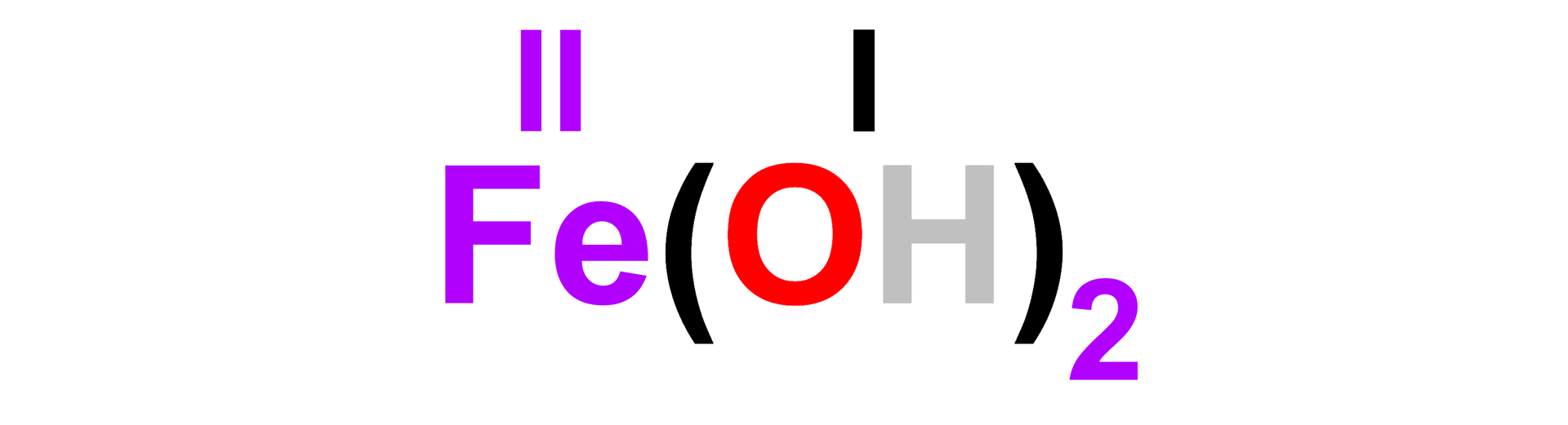
lub :

W skład sieci krystalicznej wodorotlenku żelaza() wchodzą kationy żelaza() () oraz aniony wodorotlenkowe (), a sieć krystaliczna wodorotlenku żelaza() zbudowana jest z kationów żelaza() () i anionów wodorotlenkowych ().
2. Rozpuszczalność wodorotlenków w wodzie
Wodorotlenki wykazują zróżnicowaną rozpuszczalność w wodzie. Przykładowo, wodorotlenek sodu i wodorotlenek potasu są bardzo dobrze rozpuszczalne w wodzie, podczas gdy np. wodorotlenek cynku oraz wodorotlenek glinu są właściwie nierozpuszczalne. To, czy dany wodorotlenek dobrze rozpuszcza się w wodzie, możemy sprawdzić w tabeli rozpuszczalności, której fragment znajduje się poniżej.
Przeanalizuj zamieszczony poniżej fragment tabeli rozpuszczalności wodorotlenków, a następnie zapisz wzory oraz nazwy wodorotlenków praktycznie nierozpuszczalnych w wodzie (w tabeli oznaczone jako N).

Zapoznaj się z zamieszczonymi poniżej informacjami, dotyczącymi tabeli rozpuszczalności, a następnie rozwiąż zadanie umieszczone poniżej.
Tabela rozpuszczalności obrazuje rozpuszczalność związków. Tworzy się ją w ten sposób, że na jednej osi umieszcza się kationy, a na drugiej aniony. W miejscu przecięcia się linii, wyznaczonych przez interesujący nas kation i anion, znajduje się literowe oznaczenie, które informuje o rozpuszczalności tej substancji. Tabele zwykle dotyczą rozpuszczalności w wodzie o wybranej temperaturze. Oznaczenia stosowane w tabelach:
R – substancja dobrze rozpuszczalna w wodzie;
N – substancja praktycznie nierozpuszczalna w wodzie;
T – substancja trudno rozpuszczalna w wodzie, która wytrąca się przy odpowiednim stężeniu roztworu.
Wodne roztwory wodorotlenków to tak zwane zasadyzasady. Mówiąc „zasada sodowa”, mamy więc na myśli „wodny roztwór wodorotlenku sodu”.
3. Wskaźniki
Obecność w roztworze wodnym wodorotlenku rozpuszczalnego w wodzie można wykryć, używając do tego substancji zwanych wskaźnikami kwasowo‑zasadowymiwskaźnikami kwasowo‑zasadowymi (lub indykatorami), które zmieniają swoją barwę w zależności od odczynu roztworuodczynu roztworu, będącego cechą charakteryzującą roztwory wodne.
Wielu wskaźników kwasowo–zasadowych używamy mniej lub bardziej świadomie na co dzień. Herbata, do której dodamy sok z cytryny, zmienia pod jego wpływem zabarwienie na jaśniejsze. Podobnie, gdy do soku z buraków dodamy sok z cytryny (kwas cytrynowy) lub ocet (kwas octowy) – pod wpływem wymienionych substancji przyjmie intensywny czerwony kolor.
W laboratorium chemicznym, do badania odczynu roztworów i zarazem identyfikacji niektórych substancji rozpuszczalnych w wodzie, jako wskaźników używa się między innymi alkoholowego roztworu fenoloftaleiny, wodnego roztworu oranżu metylowego oraz uniwersalnego papierka wskaźnikowego. W warunkach domowych jako indykator może posłużyć wywar z liści czerwonej kapusty.
Wodne roztwory wodorotlenków rozpuszczalnych w wodzie charakteryzują się odczynem zasadowym. Z kolei czysta woda ma odczyn obojętny. W poniższej tabeli znajdują się nazwy wybranych wskaźników kwasowo‑zasadowych oraz ich barwy, w zależności od środowiska, w jakim się znajdują (woda lub wodny roztwór wodorotlenku). Zapoznaj się z informacjami zawartymi w tabeli i odpowiedz na pytanie, czy wszystkich z wymienionych wskaźników można użyć w celu odróżnienia wody destylowanej od wodnego roztworu wodorotlenku. Odpowiedź uzasadnij.

4. Otrzymywanie wodorotlenków
Sprawdź, czy po wprowadzeniu kawałka metalicznego sodu do wody destylowanej uzyskasz roztwór o odczynie zasadowym. W tym celu przeprowadź doświadczenie Przygotuj niezbędne odczynniki i sprzęt laboratoryjny. Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie wg załączonej instrukcji. Jeśli nie masz możliwości samodzielnego przeprowadzenia doświadczenia, zapoznaj się z filmem z jego wykonania. Napisz obserwacje oraz sformułuj odpowiedni wniosek. Przeprowadzając doświadczenie, samodzielnie zadbaj o środki ochrony osobistej.
Przeprowadzono doświadczenie, w którym sprawdzono, czy po wprowadzeniu kawałka metalicznego sodu do wody destylowanej, uzyskany zostanie roztwór o odczynie zasadowym.
Problem badawczy:
Czy po wprowadzeniu sodu do wody destylowanej, można otrzymać wodny roztwór wodorotlenku sodu?
Hipoteza:
Po wprowadzeniu sodu do wody destylowanej można otrzymać wodny roztwór wodorotlenku sodu.
Co było potrzebne:
krystalizator;
woda destylowana;
wywar z czerwonej kapusty;
kawałek sodu wielkości ziarna ryżu;
pęseta;
bibuła;
nóż.
Przebieg doświadczenia:
Do krystalizatora nalano wody destylowanej i dodano kilka kropel wywaru z czerwonej kapusty. Za pomocą pęsety wyjęto sód z oleju mineralnego, dokładnie go osuszono bibułą i odkrojono kawałek wielkości ziarna ryżu. Do krystalizatora z wodą destylowaną z dodatkiem wywaru z czerwonej kapusty wrzucono przygotowany kawałek sodu (pozostałą, niewykorzystaną część sodu schowano z powrotem do oleju mineralnego). Obserwowano zachodzące zmiany.
Obserwacje:
Sód unosi się na powierzchni wody. Metaliczne ciało stałe ulega w wodzie roztworzeniu. Wydziela się bezbarwny (bezwonny) gaz. Roztwór w krystalizatorze zmienia barwę z fioletowej na zieloną. W wyniku zachodzącej przemiany, krystalizator stał się ciepły.
Wnioski:
Sód ma gęstość mniejszą od gęstości wody. Reaguje z nią, a obserwowana zmiana zabarwienia wywaru z czerwonej kapusty pozwala wnioskować, że powstaje wodny roztwór wodorotlenku sodu.

Film dostępny pod adresem /preview/resource/R1ZDsbQPCHufs
Na filmie ukazano, w jaki sposób sód reaguje z wodą. W celu zbadania odczynu powstałego roztworu, w doświadczeniu wykorzystano wywar z czerwonej kapusty.
Wywar z czerwonej kapusty, zastosowany w doświadczeniu, zmienił barwę z fioletowej na zieloną. Na tej podstawie można stwierdzić, że: Możliwe odpowiedzi: 1. wywar z czerwonej kapusty może służyć jako wskaźnik pH do wykrywania roztworów o odczynie zasadowym., 2. wywar z czerwonej kapusty może służyć jako wskaźnik pH do wykrywania roztworów o odczynie obojętnym., 3. wywar z czerwonej kapusty nie może służyć jako wskaźnik pH., 4. wywar z czerwonej kapusty może służyć jako wskaźnik pH do wykrywania roztworów o odczynie kwasowym.
Podsumowanie doświadczenia
Sód gwałtownie reaguje z wodą, a odnotowana zmiana zabarwienia wywaru z czerwonej kapusty (z fioletowego na zielony) pozwala na stwierdzenie, że w wyniku zachodzącej reakcji chemicznej uzyskano roztwór o odczynie zasadowym. Biorąc pod uwagę wykorzystane odczynniki chemiczne (sód i wodę destylowaną), można wnioskować, że substancja obecna w roztworze wodnym po reakcji to wodorotlenek sodu. Wydzielającym się gazem, w wyniku zachodzącej reakcji chemicznej, jest wodór.
Równanie reakcji chemicznej, która ma miejsce w układzie doświadczalnym, wygląda następująco:
Wykorzystując poniższą symulację, sprawdź, w jaki sposób użyte w niej metale zachowują się wobec wody. Następnie zapisz obserwacje.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/PsZwCnQcf
Wykonano doświadczenie, w którym sprawdzono, w jaki sposób reagują z wodą magnez i miedź. W tym celu próbki metali wrzucono do probówek z wodą destylowaną z dodatkiem alkoholowego roztworu fenoloftaleiny. Potem je ogrzano, a do ich wylotu zbliżono zapaloną zapałkę. Zaznacz zdanie, które poprawnie opisuje obserwacje, poczynione podczas doświadczenia.
Jedną z laboratoryjnych metod otrzymywania wodorotlenków jest reakcja niektórych metali z wodą. Tak zwane metale aktywne (a więc należące do oraz grupy układu okresowego, z wyjątkiem berylu) w większości reagują z wodą już w temperaturze pokojowej (magnez reaguje z wodą w widoczny sposób dopiero w podwyższonej temperaturze). W wyniku reakcji chemicznej metalu z wodą, oprócz wodorotlenku powstaje również wodór. Równanie omówionej reakcji chemicznej można opisać schematem:
Litowce reagują z wodą gwałtowniej niż berylowce. Do reakcji z wodą nie stosuje się jednak fransu i radu – to metale promieniotwórcze.
W obrębie grupy układu okresowego, aktywność metali rośnie ze wzrostem liczby atomowej, a w obrębie okresu – rośnie wraz ze zmniejszaniem się liczby atomowej, tak jak to przedstawiono na poniższej grafice.

Związane jest to ze zwiększającą się odległością elektronów walencyjnych od jądra atomowego w atomach metali, co skutkuje łatwością atomu do oddawania elektronów podczas tworzenia wiązań jonowych.
Metale pozostałych grup układu okresowego (np. miedź), podobnie jak wspomniany już beryl, są mniej aktywne i nie reagują z wodą. Ich trudno rozpuszczalne w wodzie wodorotlenki metali otrzymuje się innymi metodami.
Sprawdź, w jaki sposób tlenek wapnia zachowuje się wobec wody. W tym celu przeprowadź doświadczenie Przygotuj niezbędne odczynniki i sprzęt laboratoryjny. Wybierz hipotezę i zweryfikuj ją, przeprowadzając doświadczenie wg załączonej instrukcji. Napisz obserwacje oraz sformułuj odpowiedni wniosek. Przeprowadzając doświadczenie samodzielnie, zadbaj o środki ochrony osobistej.
Przeprowadzono doświadczenie, w którym sprawdzono, w jaki sposób tlenek wapnia zachowuje się wobec wody.
Problem badawczy:
Czy tlenek wapnia reaguje z wodą?
Hipoteza:
Tlenek wapnia reaguje z wodą.
Co było potrzebne:
zlewka;
tlenek wapnia;
woda destylowana;
bagietka;
termometr;
alkoholowy roztwór fenoloftaleiny.
Przebieg doświadczenia:
Do zlewki wsypano niewielką ilość tlenku wapnia. Ostrożnie dolano zimnej wody, a zawartość zlewki dokładnie wymieszano bagietką. Następnie włożono termometr do zlewki i obserwowano jego wskazania. Na końcu do zawartości zlewki dodano kilka kropli alkoholowego roztworu fenoloftaleiny.
Obserwacje:
Część użytego tlenku wapnia rozpuszcza się (lub roztwarza) w wodzie. Temperatura roztworu w zlewce rośnie. Po dodaniu alkoholowego roztworu fenoloftaleiny, roztwór zabarwia się na malinowo. Pojawia się biały osad (zmętnienie).
Wnioski:
Tlenek wapnia reaguje z wodą. Obserwowana zmiana zabarwienia zawartości zlewki, po dodaniu do niej alkoholowego roztworu fenoloftaleiny, pozwala wnioskować, że w wyniku reakcji powstaje wodny roztwór wodorotlenku wapnia. Zachodząca reakcja chemiczna jest reakcją egzotermiczną.
Na podstawie wykonanego doświadczenia można stwierdzić, że: Możliwe odpowiedzi: 1. tlenek wapnia jest tlenkiem zasadowym., 2. tlenek wapnia jest tlenkiem amfoterycznym., 3. tlenek wapnia jest tlenkiem kwasowym., 4. tlenek wapnia jest tlenkiem obojętnym.
Podsumowanie doświadczenia
Tlenek wapnia reaguje z wodą, a w wyniku zachodzącej reakcji chemicznej wydziela się ciepło – to reakcja egzoenergetyczna (egzotermiczna)reakcja egzoenergetyczna (egzotermiczna). To, że po dodaniu alkoholowego roztworu fenoloftaleiny roztwór zabarwił się na malinowo, pozwala na stwierdzenie, że w wyniku zachodzącej reakcji chemicznej uzyskano roztwór o odczynie zasadowym. Biorąc pod uwagę wykorzystane odczynniki chemiczne (tlenek wapnia i wodę destylowaną), można wnioskować, że substancja obecna w roztworze wodnym po reakcji to wodorotlenek wapnia. Równanie reakcji chemicznej, która zachodzi w trakcie wykonywania opisanego doświadczenia, ma postać:
Wykorzystując poniższą symulację, sprawdź, w jaki sposób użyte w niej tlenki metali zachowują się wobec wody. Następnie zapisz obserwacje.
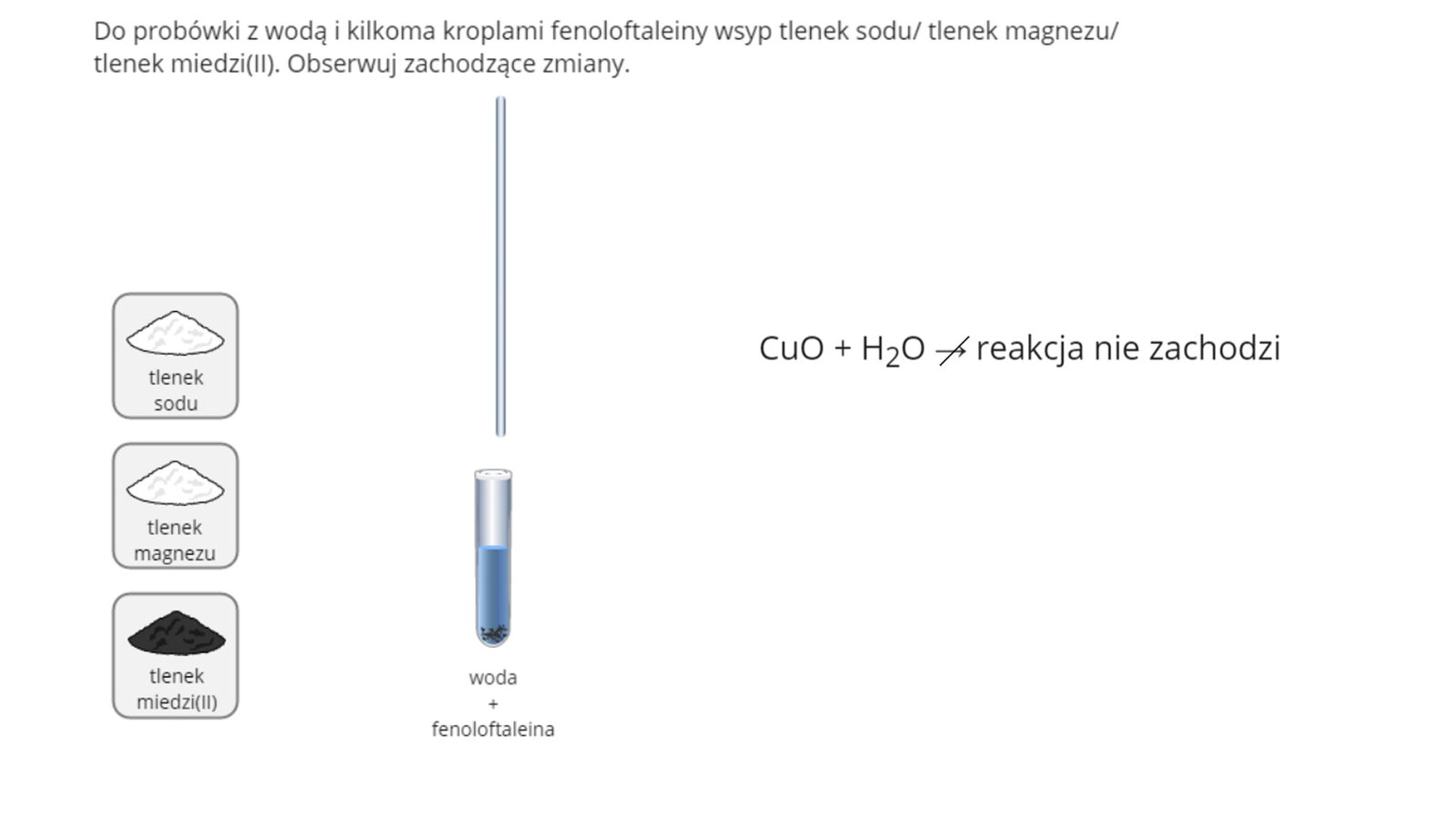
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/PsZwCnQcf
Wykonano doświadczenie, w którym sprawdzono reaktywność wybranych tlenków metali z wodą. W tym celu do trzech probówek, zawierających wodę destylowaną z dodatkiem alkoholowego roztworu fenoloftaleiny, dodano kolejno tlenek sodu, tlenek magnezu i tlenek miedzi(). Zawartość każdej probówki dokładnie wymieszano za pomocą szklanej bagietki. Zaznacz zdanie, które poprawnie opisuje obserwacje poczynione podczas doświadczenia.
Jako drugą z laboratoryjnych metod otrzymywania wodorotlenków, można zastosować reakcję tlenków niektórych metali z wodą. Do wspomnianych należą tlenki metali aktywnych. Równanie omówionej reakcji chemicznej tlenków niektórych metali z wodą można opisać schematem:
Tlenki, które w reakcji z wodą tworzą zasady (a więc wodorotlenki rozpuszczalne w wodzie), to tak zwane tlenki zasadotwórcze.
Podsumowanie
Wodorotlenki to związki chemiczne, zbudowane z kationów metali i anionów wodorotlenkowych, o wzorze ogólnym: .
Nazwy wodorotlenków tworzymy, dodając do słowa „wodorotlenek” nazwę wchodzącego w jego skład metalu (w dopełniaczu) oraz, w przypadku niektórych metali, jego wartościowość.
Wodorotlenki otrzymuje się w wyniku reakcji chemicznych niektórych metali z wodą oraz tlenków niektórych metali z wodą.
Wodne roztwory wodorotlenków dobrze rozpuszczalnych w wodzie (wszystkich wodorotlenków metali z grupy układu okresowego i wybranych wodorotlenków metali z grupy ) nazywa się zasadami.
Wykorzystując dostępne Ci źródła informacji oraz wiedzę zdobytą podczas analizy tego materiału, przygotuj infografikę przedstawiającą barwy wybranych wskaźników w środowisku o odczynie obojętnym i zasadowym.
Wykorzystując dostępne Ci źródła informacji oraz wiedzę zdobytą podczas analizy tego materiału, przyporządkuj wskaźnikom kwasowo‑zasadowym barwy, jakie przyjmują w roztworach o odczynie zasadowym.
Zapisz równania reakcji chemicznych, oznaczonych na poniższym chemografie cyframi od do . Pamiętaj, że każda z reakcji prowadzi do otrzymania odpowiedniego wodorotlenku. Napisz wzory (lub symbole) i nazwy substancji oznaczonych literami od A do H. Określ typ każdej z reakcji chemicznych (synteza, analiza, wymiana).
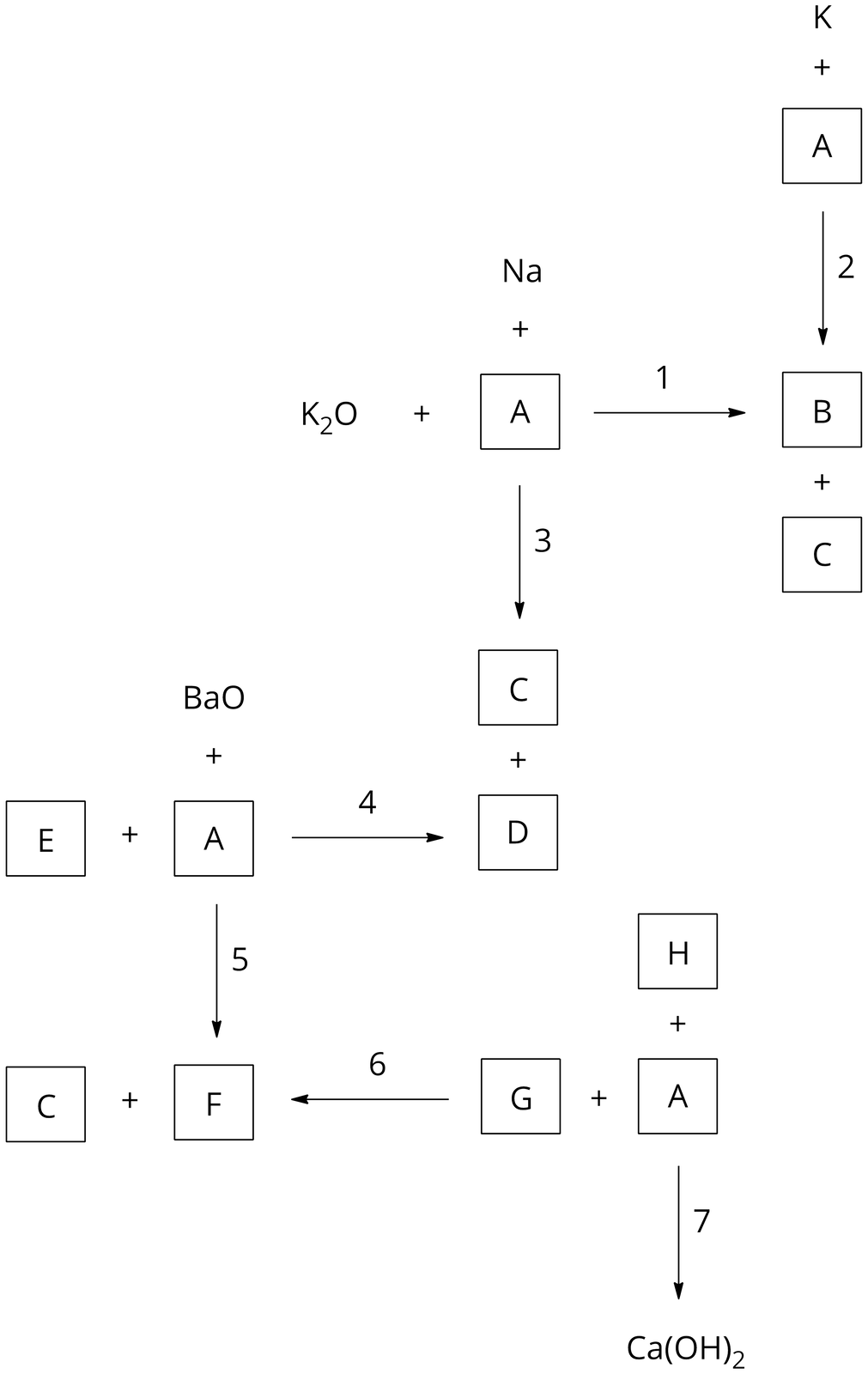
Przyporządkuj poniższym reakcjom z udziałem wodorotlenków ich odpowiedni typ.
Słownik
pojęcie abstrakcyjne, matematyczne, oznaczające powtarzające się w przestrzeni upakowanie drobin (pod określonymi kątami i w określonej odległości)
związek chemiczny, zbudowany z kationów metalu i anionów wodorotlenkowych
wodny roztwór dobrze rozpuszczalnego wodorotlenku
(indykatory) substancje chemiczne, które zmieniają swoją barwę w zależności od odczynu środowiska (roztworu), w którym się znajdują
cecha charakteryzująca roztwory wodne; roztwór może mieć odczyn kwasowy (np. ocet), obojętny (np. wodny roztwór soli kuchennej) lub zasadowy (wodne roztwory wodorotlenków)
reakcja chemiczna, w wyniku której z układu reakcyjnego (doświadczalnego) do otoczenia wydziela się ciepło
Ćwiczenia
aktywny metal 1. woda, 2. tlenek niemetalu, 3. każdy metal, 4. tlenek metalu aktywnego, 5. wodorotlenek, 6. tlenek każdego metalu, 7. wodorotlenek woda, 8. wodorotlenek wodór, 9. tlen, 10. wodór, 11. wodór, 12. woda, 13. tlen, 14. wodorotlenek tlen, 15. każdy niemetal 1. woda, 2. tlenek niemetalu, 3. każdy metal, 4. tlenek metalu aktywnego, 5. wodorotlenek, 6. tlenek każdego metalu, 7. wodorotlenek woda, 8. wodorotlenek wodór, 9. tlen, 10. wodór, 11. wodór, 12. woda, 13. tlen, 14. wodorotlenek tlen, 15. każdy niemetal
Przedstaw metody otrzymywania wodorotlenków, wybierając odpowiednie elementy z listy.
aktywny metal, tlen, tlen, wodorotlenek, każdy niemetal, wodorotlenek + tlen, tlenek niemetalu, tlenek metalu aktywnego, wodorotlenek + wodór, wodorotlenek + wodór, wodorotlenek, wodór, wodorotlenek + woda, każdy metal, wodorotlenek + tlen, wodorotlenek + woda, tlenek każdego metalu, wodór
.............................................. ..............................................
.............................................. ..............................................
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9.
1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9. 1. , 2. , 3. , 4. , 5. , 6. , 7. , 8. , 9.
Uzupełnij równania reakcji otrzymywania wodorotlenków, przeciągając w luki odpowiednie symbole lub wzory chemiczne substancji.
, , , , , , , ,
....................................................
....................................................
.................................................... ....................................................
Oceń prawdziwość podanych informacji.
| Prawda | Fałsz | |
| Wszystkie metale reagują z wodą. | □ | □ |
| W wyniku reakcji metalu aktywnego z wodą powstaje wodorotlenek i wydziela się wodór. | □ | □ |
| W wyniku reakcji miedzi z wodą powstaje wodorotlenek miedzi. | □ | □ |
| Miedź jest metalem bardziej aktywnym niż sód. | □ | □ |
| W wyniku reakcji tlenku potasu z wodą wydziela się wodór. | □ | □ |
Znając zachowanie się miedzi, magnezu i sodu w wodzie z dodatkiem alkoholowego roztworu fenoloftaleiny, ustal, jakich metali użyto do kolejnych reakcji.

Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/PsZwCnQcf
Analizując informacje zawarte w poniższej tabeli, dopasuj do odpowiednich komórek nazwy wskaźników kwasowo‑zasadowych, którym odpowiadają podane barwy.
Uczeń przeprowadził doświadczenie, zilustrowane na poniższym schemacie.

Uczeń przygotował cztery zlewki, w których znajdowała się woda destylowana z dodatkiem alkoholowego roztworu fenoloftaleiny. Następnie do każdej z nich wprowadził inny tlenek (wszystkie tlenki znajdowały się w postaci ciał stałych). Do zlewki nr został dodany tlenek cynku, do zlewki nr tlenek baru, do zlewki nr tlenek potasu, a do zlewki nr tlenek
żelaza().
W szkolnym laboratorium chemicznym przeprowadzono doświadczenie zilustrowane na poniższym schemacie.

W szkolnym laboratorium chemicznym przeprowadzono pewne doświadczenie. Przygotowano dwie kolby stożkowe, do których nalano wody destylowanej. Do kolby nr 1 wprowadzono próbkę metalicznego glinu, a do kolby nr próbkę metalicznego wapnia.
Bibliografia
Encyklopedia PWN.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
Litwin M., Styka‑Wlazło Sz., Szymońska J., To jest chemia 1. Chemia ogólna i nieorganiczna. Zakres roz szerzony, Warszawa 2012.
Pazdro K. M., Chemia. Pierwiastki i związki nieorganiczne, Warszawa 2012.
