Izotopy pierwiastków
Pierwiastek chemiczny to zbiór atomów, które posiadają taką samą liczbę protonów w jądrze atomowym. Czy wiesz, że atomy tego samego pierwiastka mogą różnić się między sobą liczbą pewnych elementów budowy? Zapoznaj się z poniższym materiałem, a dowiesz się m.in. o jakie elementy budowy atomów chodzi.
budowę atomów;
cząstki wchodzące w skład jadra atomowego;
symboliczny zapis atomu danego pierwiastka chemicznego
definicje liczby atomowej i liczby masowej.
uporządkowanie pierwiastków w układzie okresowym;
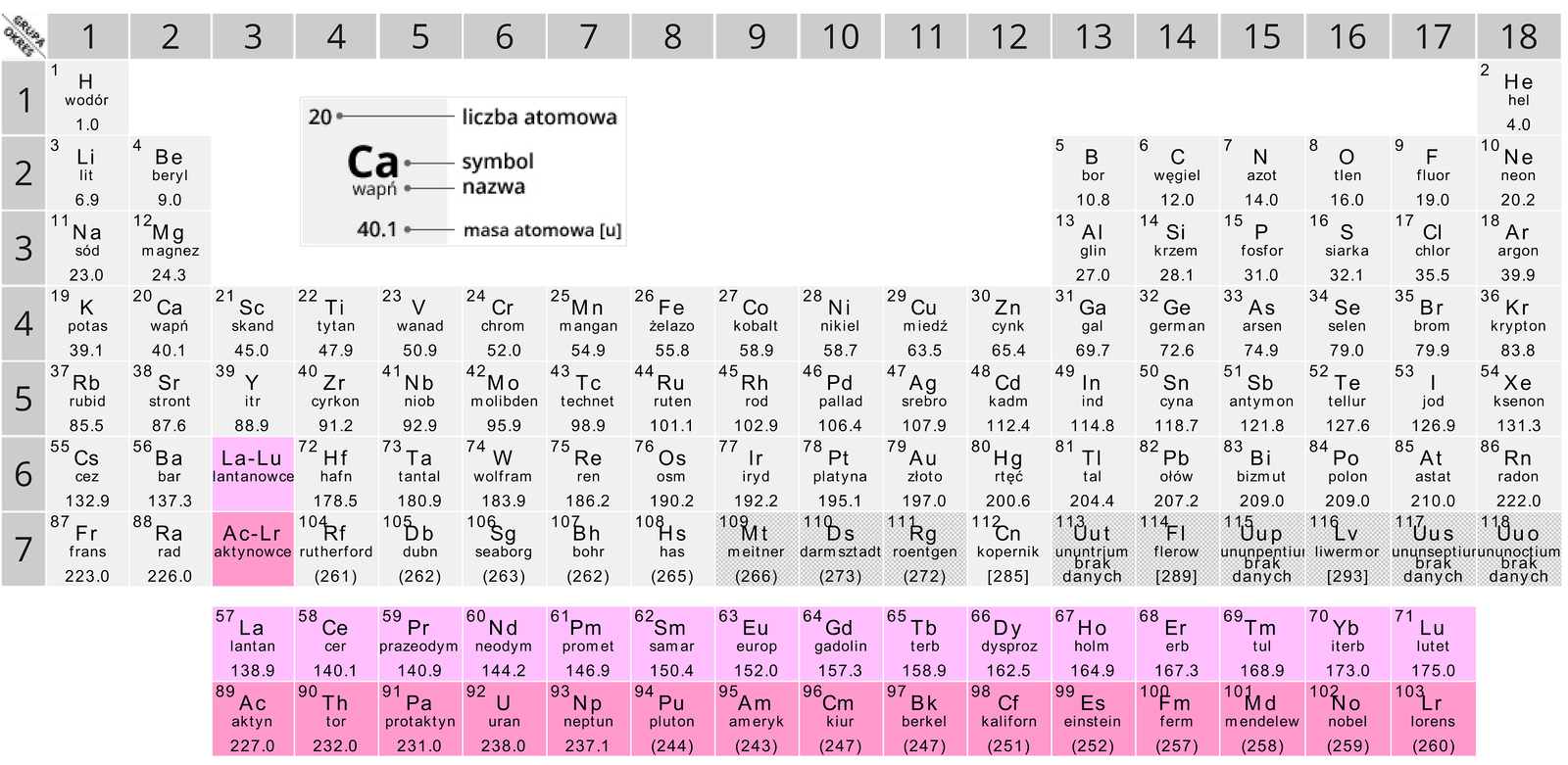
sposób odczytu podstawowych informacji o pierwiastkach (symbol, nazwa, liczba atomowa, masa atomowa, rodzaj pierwiastka – metal lub niemetal) z układu okresowego.
wyjaśniać, co to są izotopy;
opisywać izotopy za pomocą symboli;
omawiać różnice w budowie atomów izotopów wodoru;
obliczać masę izotopu;
obliczać średnią masę atomową pierwiastka chemicznego.
1. W jaki sposób atomy tego samego pierwiastka chemicznego mogą się różnić między sobą?
Atomy określonego pierwiastka chemicznegopierwiastka chemicznego mają jednakowy ładunek jądra atomowego (identyczną liczbę protonów) oraz taką samą liczbę poruszających się wokół jądra atomowego elektronów. Jednak, jak się okazuje, atomy te mogą różnić się masą. Przyczyną tego zjawiska jest możliwość występowania w jądrach atomów określonego pierwiastka różnej liczby neutronów. Te atomy, które mają w jądrach atomowych więcej neutronów, mają większą masę.
Atomy danego pierwiastka chemicznego, które zawierają jednakową liczbę protonów, a różnią się liczbą neutronów w jądrze atomowym, to tzw. izotopyizotopy (gr. izo „taki sam”, topos „miejsce”).
Zastanów się i odpowiedz na pytanie, czy izotopy tego samego pierwiastka mają jednakowe liczby: atomową i masową. Odpowiedź uzasadnij, odwołując się do definicji wskazanych liczb: atomowej i masowej.
Azot ma ponad 16 izotopów. Przeanalizujmy dwa z nich. W jądrze atomowym jednego z izotopów azotu znajduje się siedem, a w jądrze atomowym drugiego – osiem neutronów. Każdy z tych izotopów ma taką samą liczbę protonów, którą można odczytać z układu okresowego.

Uwaga! Jako Izotop 1 ustaw ten izotop, który posiada mniejszą liczbę masową.
W opisie izotopów poszczególnych pierwiastków chemicznych istotna jest informacja dotycząca liczby neutronów, które zawierają. Informację o liczbie neutronów można pozyskać, znając liczbę nukleonów, a więc liczbę masową (A) oraz liczbę protonów – liczbę atomową (Z). Jak już ustaliliśmy, izotopy danego pierwiastka różnią się liczbami masowymi, ale mają takie same liczby atomowe. Dlatego w opisie budowy atomu oraz w nazwach określonych izotopów wykorzystuje się głównie liczbę masową. Liczba atomowa w symbolicznym zapisie budowy izotopu oraz w jego nazwie najczęściej jest pomijana (można ją znaleźć w układzie okresowym).
Aby wskazać na to, jaki izotop rozpatrujemy, podajemy jego nazwę lub zapis symboliczny. Nazwę izotopu tworzymy z nazwy odpowiedniego pierwiastka chemicznego, dodając do niej łącznik „-” i liczbę masową interesującego nas izotopu:
W symbolicznym zapisie izotopu najczęściej podajemy symbol pierwiastka, a w lewym górnym rogu tego symbolu umieszczamy liczbę masową:
Czasem zdarza się jednak, że w symbolicznym zapisie izotopu uwzględnia się także liczbę atomową:
2. Czy izotopy można znaleźć w przyrodzie?
Dany pierwiastek chemiczny może mieć nawet kilkadziesiąt izotopów. Jednak najczęściej nie wszystkie te izotopy są trwałe (stabilne) i nie wszystkie występują naturalnie na Ziemi. Część z nich to izotopy nietrwałe, czyli takie, które ulegają odpowiednim przemianom, określanych mianem przemian promieniotwórczychprzemian promieniotwórczych. W ich wyniku mogą powstać izotopy tego samego bądź innego pierwiastka. Samym zaś przemianom towarzyszy emisja promieniowania. Izotopy nietrwałe nazywane są często izotopami promieniotwórczymi. Znane są pierwiastki chemiczne, które w ogóle nie mają izotopów trwałych (np. pluton).
Pierwiastki chemiczne występują w przyrodzie zazwyczaj jako mieszanina izotopów o określonym składzie procentowym. Skład ten jest stały i nie zależy ani od położenia geograficznego, ani od rodzaju minerału, z którego pozyskano określony pierwiastek chemiczny.
Znane są również pierwiastki, które występują w przyrodzie w postaci jednego izotopu (jednego rodzaju atomów). Sytuacja taka ma miejsce np. w przypadku sodu i fluoru.
Na Ziemi występują pierwiastki chemiczne o liczbie atomowej do 92 włącznie (oprócz technetu i prometu). Z kolei pierwiastki chemiczne o liczbie atomowej do 83 są trwałe. Z uwagi na brak w środowisku naturalnym technetu i prometu, na Ziemi istnieje 81 pierwiastków chemicznych o trwałych izotopach.
Zasób interaktywny dostępny pod adresem https://zpe.gov.pl/b/Pb6knivus
– pierwiastki mające trwałe izotopy
– pierwiastki występujące na Ziemi
Skład izotopowy pierwiastków chemicznych. Klikając na dany pierwiastek chemiczny występujący naturalnie, wyświetlisz informację o procentowej zawartości poszczególnych jego izotopów w przyrodzie
Procentowa zawartość danego izotopu w pierwiastku chemicznym, który występuje naturalnie w przyrodzie, określana jest często mianem abundancji. Przykładowo, abundancja izotopu siarki‑32 jest równa 95 %.
3. Ile izotopów wodoru występuje w przyrodzie?
Wodór występujący w przyrodzie jest mieszaniną głównie dwóch trwałych izotopów: wodoru‑1 (99,985 %) i wodoru‑2 (0,015 %). Oznacza to, że na 100 000 atomów wodoru, aż 99 985 atomów to izotopy wodoru‑1, a tylko 15 atomów to izotopy wodoru‑2. W górnych warstwach atmosfery, w śladowych ilościach może występować również nietrwały izotop wodoru – wodór‑3. Wymienione izotopy wodoru jako jedyne w świecie izotopów pierwiastków chemicznych otrzymały swoje nazwy. Nazwy te to kolejno: prot, deuter, tryt.

Izotopy wodoru (tak jak izotopy innych pierwiastków chemicznych) różnią się liczbą nukleonów. Stąd istnieje między nimi duża różnica mas, np. atom deuteru ma masę dwukrotnie większą od masy atomu protu, a tryt aż trzykrotnie większą. Różnice w masach atomowych poszczególnych izotopów wodoru skutkują ich odmiennymi właściwościami fizycznymi. W poniższej tabeli zestawiono wybrane wielkości fizyczne, które opisują gazowy wodór. Jego cząsteczki zostały utworzone kolejno z atomów protu , deuteru i trytu .
Izotop | Symbol izotopu | Gęstość [g/dmIndeks górny 33] | Temperatura topnienia [K] | Temperatura wrzenia [K] |
prot, H | 0,08233 | 13,83 | 20,27 | |
deuter, D | 0,1645 | 18,73 | 23,67 | |
tryt, T | 0,2464 | 20,62 | 25,04 |
Indeks górny Źródło: W. Mizerski, Tablice Chemiczne, Adamantan, 2004. Indeks górny koniecŹródło: W. Mizerski, Tablice Chemiczne, Adamantan, 2004.
Na podstawie odpowiednich obliczeń porównaj objętość, jaką zajmuje 1 kg wodoru utworzonego wyłącznie z protu, z objętością, jaką zajmuje 1 kg wodoru utworzony wyłącznie z deuteru. Objętość obydwu próbek podaj w metrach sześciennych (mIndeks górny 33), z dokładnością do drugiego miejsca po przecinku. Skorzystaj z danych zawartych w powyższej tabeli.
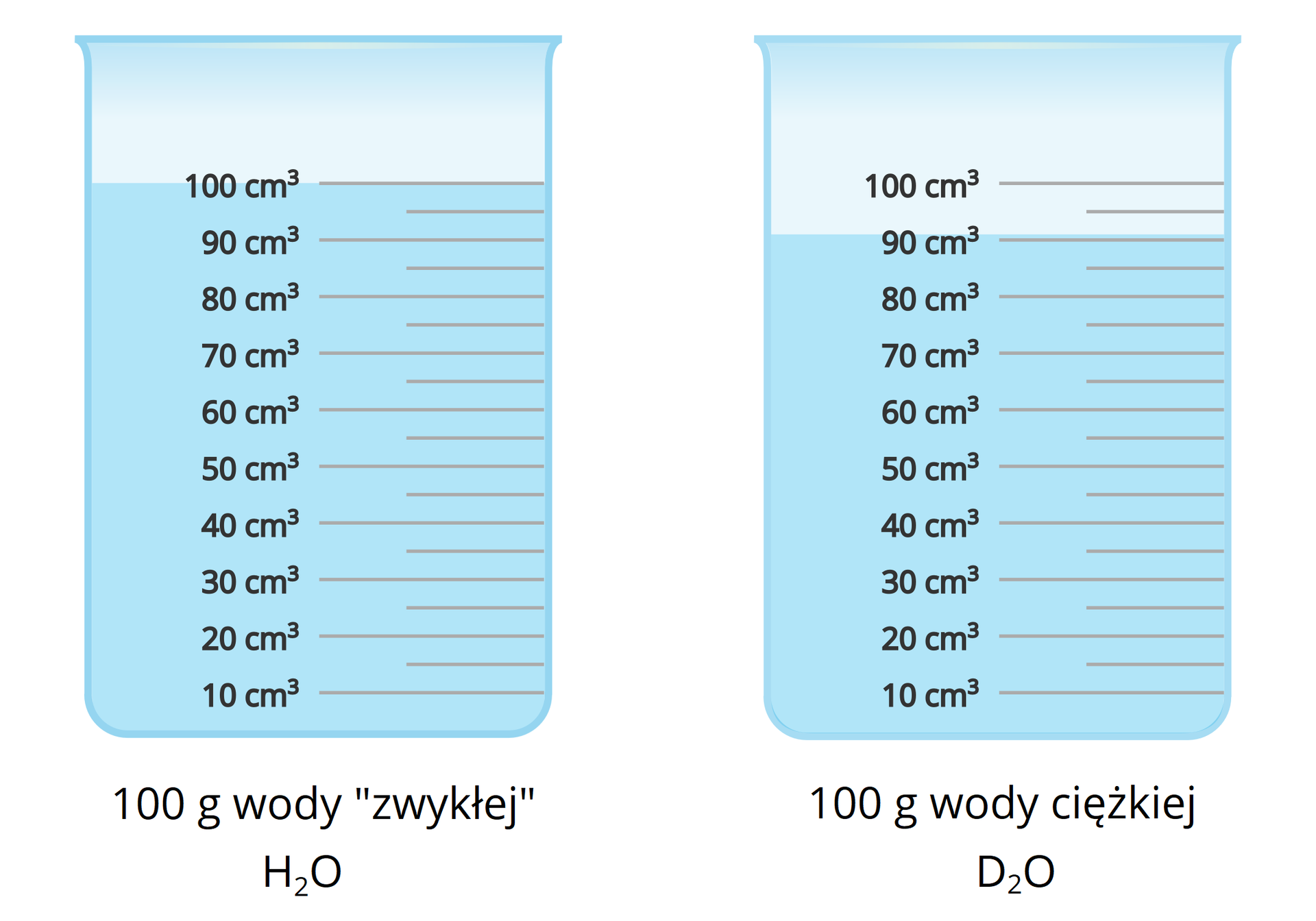
Zawarty w cząsteczkach wody, poza tlenem, wodór ma charakterystyczny dla siebie skład izotopowy. Obok protu, w bardzo małych ilościach, występuje w wodzie także deuter. Możliwe jest uzyskanie próbek wody składającej się z tlenu i tylko jednego izotopu wodoru – deuteru. Taką wodę określa się mianem wody ciężkiej i opisuje często wzorem . Różni się ona pod względem właściwości fizycznych od „zwykłej” wody utworzonej z protu i tlenu . Ciężka woda ma m.in. większą gęstość oraz wyższe temperatury wrzenia i topnienia niż woda „zwykła”.
Rodzaj wody | Gęstość w temperaturze | Temperatura topnienia | Temperatura wrzenia |
woda „zwykła” – zbudowana z protu i tlenu; może zawierać śladowe ilości wody ciężkiej | 0,998 | 0,00 | 99,974 |
woda ciężka – zbudowana z deuteru i tlenu | 1,1044 | 3,81 | 101,42 |
Z uwagi na różną gęstość, ta sama masa wody ciężkiej i „zwykłej” ma inną objętość.
4. Gdzie człowiek wykorzystuje izotopy?
Izotopy znalazły zastosowanie w różnych dziedzinach życia człowieka. Niektóre z nich wykorzystuje się w medycynie, badaniach naukowych, energetyce, przemyśle, a nawet w gospodarstwie domowym. Wybrane przykłady zastosowań izotopów omówiono na poniższej grafice interaktywnej. Zapoznaj się z nimi.
Korzystając z dostępnych źródeł informacji (np. encyklopedii, podręczników lub Internetu), sporządź notatkę, w której opiszesz krótko zastosowanie przynajmniej sześciu konkretnych izotopów wybranych pierwiastków chemicznych. Możesz ją przygotować w formie mapy pojęć, używając poniższego generatora. W tym celu kliknij przycisk „Edytuj” znajdujący się w prawym górnym rogu pola polecenia.
5. Jakie masy mają izotopy?
Atomy poszczególnych pierwiastków chemicznych oraz wchodzące w ich skład cząstki mają niewyobrażalnie małe rozmiary. Aby podać w miarę dokładną masę atomu (lub budującej go cząstki) w gramach lub kilogramach, musielibyśmy użyć bardzo dużej ilości cyfr. Przykładowo, wyrażona w gramach masa protonu byłaby równa ok.: (lub w notacji wykładniczej: ). Przyznaj, że używanie takich liczb jest nieco kłopotliwe. Dlatego też do wyrażania mas indywiduów chemicznych (np. atomów, cząsteczek, jonów czy też cząstek, które wchodzą w ich skład) wykorzystujemy odpowiednio dobrane atomowe jednostki masyatomowe jednostki masy. Jednostki te oznaczane są w skrócie literą „u” (z ang. unit = jednostka).
W poniższej tabeli zamieszczono masy cząstek budujących atomy, wyrażone w atomowych jednostkach masy.
Nazwa cząstki | Symbol | Masa cząstki wyrażona w atomowych jednostkach masy [u] |
elektron | e (eIndeks górny ––) | |
proton | p (pIndeks górny ++) | ok. 1 |
neutron | n (nIndeks górny 00) | 1 |
Z uwagi na ogromne różnice między masą elektronu a masą nukleonów (protonu i neutronu), można stwierdzić, że o masie atomu decyduje przede wszystkim liczba obecnych w nim protonów i neutronów, a więc prawie cała masa atomu jest skupiona w jego jądrze.
Masy protonu i neutronu są w przybliżeniu takie same i wynoszą ok. 1 u (czyt. jeden unit lub jedną jednostkę masy atomowej). Z wystarczającą w naszych szkolnych obliczeniach dokładnością można zatem uznać, że masa danego izotopu, wyrażona w unitach (jednostkach masy atomowej), jest liczbowo równa sumie liczb protonów i neutronów w jądrze atomowym tego izotopu. Innymi słowy – liczba masowa danego izotopu jest liczbowo równa jego masie atomowej wyrażonej w atomowych jednostkach masy [u].
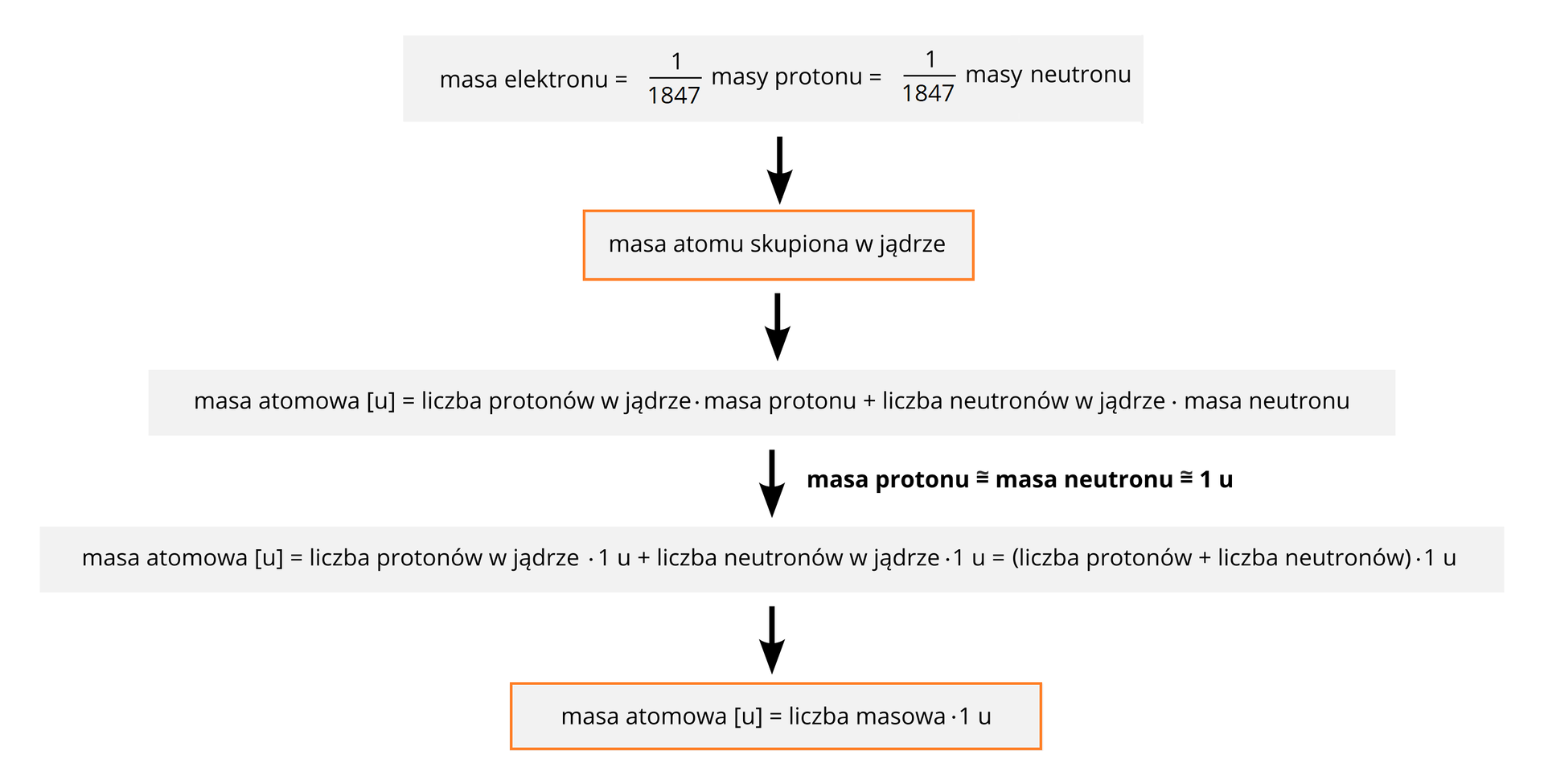
Korzystając z powyższych informacji, łatwo można obliczyć, że masa atomowa protu wynosi ok. 1 u, deuteru ok. 2 u, natomiast trytu – ok. 3 u.
6. Średnia masa atomowa pierwiastków
Zwróć uwagę, że masa atomowa zapisana w układzie okresowym ma wartość ułamkową. Dla pierwiastków chemicznych, które występują w przyrodzie w postaci mieszaniny izotopów, masa atomowa podana w układzie okresowym jest bowiem średnią, obliczoną na podstawie mas i zawartości procentowych poszczególnych naturalnie występujących izotopów danego pierwiastka (tzw. abundancji). Jest to tzw. średnia ważona. Przy jej obliczaniu bierzemy pod uwagę fakt, że każdy izotop ma swój udział w masie atomowej danego pierwiastka.
Analogicznie jest w przypadku próby określenia średniej masy ciała uczniów w klasie na podstawie informacji, że 5 % z nich ma masę 40 kg, następne 15 % ma masę 60 kg, a pozostali, czyli 80 % uczniów, mają masę po 50 kg. Wówczas średnia masa wszystkich uczniów wynosiłaby 51 kg.
Wynik to 51 kg, mimo że nikt z uczniów nie ma takiej masy ciała.
Tak samo jest z pierwiastkami chemicznymi – do obliczania średnich mas atomowychśrednich mas atomowych pierwiastków można posłużyć się następującym wzorem:
lub używając skrótów:
gdzie:
– masy poszczególnych izotopów pierwiastka, [u];
– zawartości procentowe poszczególnych izotopów
pierwiastka, [%].
Naturalnie występujący wodór jest mieszaniną dwóch izotopów – protu i deuteru – których zawartość procentowa wynosi kolejno 99,985 % i 0,015 %. Oblicz średnią masę atomową wodoru. Wynik podaj w jednostkach masy atomowej (unitach), z dokładnością do drugiego miejsca po przecinku.
Wyznacz średnią masę atomową potasu, wiedząc, że jest mieszaniną trzech naturalnie występujących izotopów o liczbach masowych 39, 40 i 41. Zawartość procentowa tych izotopów wynosi kolejno: 93,2581 %, 0,0117 % i 6,7302 %. Wynik podaj w jednostkach masy atomowej (unitach), z dokładnością do drugiego miejsca po przecinku.
Jeśli odszukasz (np. w tablicach chemicznych) dokładne masy poszczególnych izotopów danego pierwiastka chemicznego, to prawdopodobnie okaże się, że nie są one liczbami całkowitymi. Z naszych rozważań wynikałoby, że masa izotopu powinna być równa liczbowo sumie liczby zawartych w nim protonów i neutronów. Jest to jednak tylko pewne przybliżenie. Po pierwsze (jak już wspomnieliśmy) 1 u to przybliżona masa jednego protonu lub jednego neutronu. Poza tym faktyczna masa izotopu jest mniejsza niż suma mas zawartych w nich nukleonów. Deficyt (ubytek) masy związany jest z energią niezbędną do utworzenia jądra atomowego z cząstek. W myśl wzoru Alberta Einsteina masa i energia są równoważne. W uproszczeniu możemy powiedzieć, że podczas tworzenia się jądra atomowego, część masy nukleonów, które wchodzą w jego skład, zostaje przetworzona na energię, niezbędną do utrzymania tego jądra.
Podsumowanie
Izotopy są to atomy tego samego pierwiastka chemicznego, które mają jednakową liczbę protonów oraz różną liczbę neutronów.
Większość pierwiastków chemicznych, które występują w przyrodzie, stanowi mieszaninę izotopów o stałym składzie.
Izotopy wodoru to prot (), deuter () i tryt (). Różnią się właściwościami fizycznymi.
Izotopy mają zastosowanie m.in. w medycynie (w obrazowaniu i leczeniu zmian nowotworowych), w przemyśle (do otrzymywania energii), w badaniach naukowych (do określania wieku materiałów pochodzenia organicznego oraz określania przebiegu przemian jednych substancji w drugie).
Masa atomowa pierwiastka chemicznego jest średnią masą atomową obliczoną z uwzględnieniem jego składu izotopowego.
Masa izotopu jest w przybliżeniu liczbowo równa jego liczbie masowej, ale wyraża się ją w jednostkach masy atomowej (unitach).
Chlor występujący w przyrodzie jest mieszaniną dwóch izotopów. Jeden z nich zawiera w jądrze atomowym 18 neutronów, a drugi 20 neutronów. Zawartość procentowa izotopu chloru o mniejszej masie wynosi ok. 75,77 %. Oblicz średnią masę atomową chloru. Wynik podaj w jednostkach masy atomowej (unitach), z dokładnością do drugiego miejsca po przecinku.
Korzystając z dostępnych źródeł informacji (np. encyklopedii lub Internetu), wyjaśnij, dlaczego nie można wykorzystać metody określania wieku materiałów pochodzenia organicznego, na podstawie zawartości nietrwałego izotopu węgla‑14, do oceny wieku pokładów węgla kamiennego i ropy naftowej.
Słownik
jednostka masy używana do wyrażania mas indywiduów chemicznych (m.in. atomów, jonów, cząsteczek oraz cząstek, które je budują)
(gr. izo „taki sam”, topos „miejsce”)
atomy tego samego pierwiastka, które mają jednakową liczbę atomową (liczbę protonów w jądrze atomowym) i różną liczbę masową, a dokładniej – różną liczbę neutronów w jądrze atomowym
zbiór atomów o takiej samej liczbie atomowej, a więc o takiej samej liczbie protonów w jądrach atomowych
w uproszczeniu – samorzutna przemiana nietrwałych (niestabilnych) izotopów, w wyniku której powstają nowe izotopy, będące zwykle izotopami innego pierwiastka chemicznego; przemianie promieniotwórczej towarzyszy emisja odpowiedniego promieniowania
średnia ważona, obliczona w oparciu o znajomość mas i zawartości procentowych poszczególnych izotopów, wchodzących w skład naturalnie występującego pierwiastka chemicznego; średnia masa atomowa wyrażana jest w atomowych jednostkach masy [u]
Ćwiczenia
Wskaż zapis przedstawiający izotop chloru, którego jądro zawiera 20 neutronów.
Oblicz, jaką przybliżoną masę atomową ma izotop kobaltu: . Wybierz właściwą odpowiedź.
- 59 u
- 32 u
- 86 u
- 27 u
Oblicz, jaką masę atomową ma izotop jodu, jeśli w jego jądrze znajdują się 74 neutrony. Wskaż właściwą odpowiedź.
- 127 u
- 74 u
- 53 u
- 21 u
Oceń, czy podane zdania są prawdziwe, czy fałszywe.
| Prawda | Fałsz | |
| Każdy z pierwiastków składa się z co najmniej dwóch izotopów. | □ | □ |
| Wszystkie izotopy danego pierwiastka mają jednakową masę. | □ | □ |
| Tryt zawiera trzy nukleony. | □ | □ |
| Masa prezentowana przy symbolu pierwiastka w układzie okresowym jest masą najpowszechniej występującego izotopu tego pierwiastka. | □ | □ |
| Masa izotopu jest równa liczbowo w przybliżeniu sumie jego protonów i neutronów. | □ | □ |
Oblicz średnią masę atomową żelaza, jeśli jego skład izotopowy jest następujący: , , , . Wskaż poprawną odpowiedź.
- 55,8546 u
- 56,2500 u
- 56,000 u
Oblicz, jaką masę wyrażoną w atomowych jednostkach masy ma 10 000 atomów miedzi, jeśli skład izotopowy tego pierwiastka jest następujący: , Wskaż właściwą odpowiedź.
- 636 166 u
- 10 000 u
- 65 000 u
- 630 000 u
- 29 u
- 63,616 u
Bibliografia
Encyklopedia PWN.
Kaznowski K., Pazdro K. M., Chemia, Podręcznik do liceów i techników cz. 1, Warszawa 2019.
Czaja M., Karawajczyk B., Kwiatkowski M., Chemia, Podręcznik dla szkół ponadpodstawowych (zakres rozszerzony), Gdynia 2019.
Krzeczkowska M., Loch J., Mizera A., Repetytorium chemia. Liceum – poziom podstawowy i rozszerzony, Warszawa – Bielsko‑Biała 2010.
