W chemii często posługujemy się takimi określeniami jak „roztwór stężony”, „roztwór rozcieńczony” oraz „roztwór nasycony”, jednak podają nam one wyłącznie ogólny zarys czy substancji w roztworze jest dużo, czy mało. Istnieje jednak kilka metod na dokładne określenie, jaki ilościowo jest jego skład. O jednej z nich przeczytasz w poniższym artykule.

Definicja stężenia procentowego
Pojęcie stężenia oznacza skalę ilości substancji znajdującej się w danym roztworze. Stężenie możemy podawać w jednostkach zależnych od wielkości jakimi się posługujemy, np. w molach, gramach lub procentach. Stężenie procentowe informuje nas, ile części masowych rozpuszczonej substancji znajduje się w 100 częściach masowych roztworu. Innymi słowy, jest to liczba gramów substancji rozpuszczonej w 100 g roztworu. Przykładowo, jeżeli kupimy mleko 3,2%, oznacza to, że w 100 g mleka znajduje się 3,2 g tłuszczu. Stężenie procentowe oznaczamy symbolem Cp.
Wzór ogólny na stężenie procentowe
Aby wyprowadzić wzór na stężenie procentowe, należy pamiętać, że masa roztworu (mr) jest nie tylko masą rozpuszczalnika (mrozp), ale również rozpuszczonej w nim substancji (ms):
mr = mrozp + ms
Biorąc za przykład roztwór 4-procentowy o masie 100 g wiemy, że Cp = 4%, więc masa substancji to 4 g. Z definicji stężenia procentowego wynika, że skoro masa roztworu to 100 g, masa rozpuszczalnika wynosi 96 g.
Stężenie procentowe można obliczyć, wykorzystując wzór:
Cp = (ms/mr) · 100%
Ze wzoru wynika, że znając masę roztworu oraz masę substancji możemy łatwo wyliczyć stężenie procentowe. Na przykład wiedząc, że roztwór ma masę równą 450 g, a substancji w nim rozpuszczonej jest 15 g, wstawiając do wzoru, otrzymujemy:
Cp = (15/450) · 100% = 3,3%
Obliczanie masy poszczególnych składników roztworu
Każdy wzór, również ten na stężenie procentowe, można przekształcić. Znając stężenie procentowe roztworu oraz jego masę, można obliczyć masę substancji w nim rozpuszczonej. Analogicznie znając stężenie procentowe oraz masę substancji, można obliczyć masę roztworu. Oprócz przekształceń wzoru możliwe jest też wykorzystanie odpowiednich proporcji.
Przykład 1. Ile gramów cukru potrzeba do sporządzenia 300g 10% roztworu?
Z treści zadania wiemy, że masa roztworu wynosi 300g, a jego stężenie procentowe to 10%. Wyznaczenie masy substancji rozpuszczonej jest możliwe na dwa sposoby.
Sposób 1. Przekształcenie wzoru
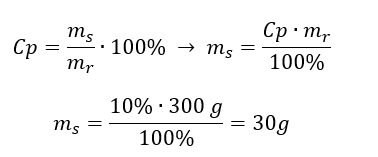
Sposób 2. Wykorzystanie proporcji wiedząc, że roztwór 10% zawiera 10g cukru w 100g roztworu
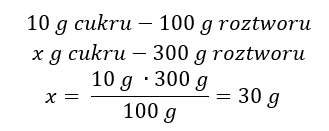
Wynikiem obu sposobów rozwiązania jest, że do sporządzenia 300g 10% roztworu należy użyć 30g cukru.

Przykład 2. W ilu gramach wody należy rozpuścić 10g substancji, aby otrzymać roztwór 50%?
Z treści zadania wiemy, że masa substancji wynosi 10g, a stężenie procentowe roztworu to 50%. Oznacza to, że w 100 g roztworu znajduje się 50g substancji. Wyznaczenie masy roztworu jest możliwe na dwa sposoby. Należy pamiętać, że masa roztworu nie równa się masie rozpuszczalnika. W celu obliczenia masy rozpuszczalnika należy od masy roztworu odjąć masę substancji.
Sposób 1. Przekształcenie wzoru
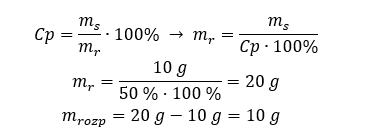
Sposób 2. Wykorzystanie proporcji wiedząc, że w 100g roztworu znajduje się 50g substancji.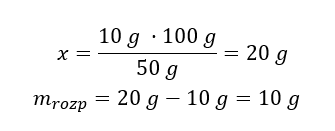
Rozwiązaniem zadania przy użyciu dwóch metod jest, że w celu otrzymania 50% roztworu należy rozpuścić 10g substancji w 10g wody.
Sporządzanie roztworów
Kluczowym elementem pracy w laboratorium jest zdolność do sporządzania roztworów o zadanych stężeniach. W tym celu konieczna jest wiedza na temat masy jego składników. Wcześniej obliczoną masę substancji należy rozpuścić w dokładnie odmierzonej objętości rozpuszczalnika. Potrzebną objętość można obliczyć, znając masę oraz gęstość cieczy. Gęstość roztworu jest charakterystyczną dla danej cieczy wielkością fizyczną, która określa jego masę dla konkretnej jednostki objętości. Wartość jest silnie zależna od temperatury. Wiedząc, że gęstość roztworu jest równa 2,03 g/ml wiemy, że 1ml danego roztworu ma masę 2,03g. Najczęściej stosuje się jednostki gęstości: g/ml = g/cm3, g/l = g/dm3, ale można również spotkać inne, na przykład kg/m3. Gęstość roztworu wyrażona jest wzorem: dr=mr/vr, gdzie mr oznacza masę roztworu, a Vr jego objętość. Znając objętość danego roztworu oraz jego gęstość, możemy obliczyć jego masę.
Przykład 3. Jaką masę ma 20ml roztworu, którego gęstość wynosi 1,201 g/ml?
Sposób 1. Przekształcenie wzoru
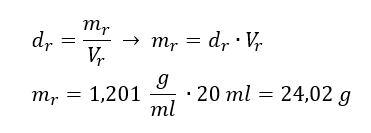
Sposób 2. Wykorzystanie proporcji wiedząc, że 1,201g roztworu zajmuje objętość 1ml

Obydwa sposoby wykazały, że roztwór o gęstości 1,201 g/ml, zajmujący 20ml, ma masę równą 24,02g.
Znajomość pojęcia gęstości pozwala nam prowadzić jeszcze więcej obliczeń na stężeniu procentowym.
Przykład 4. Ile gramów soli znajduje się w 10ml roztworu o stężeniu 15%, jeżeli jego gęstość wynosi 1,035 g/ml?
Sposób 1. Przekształcenie wzorów
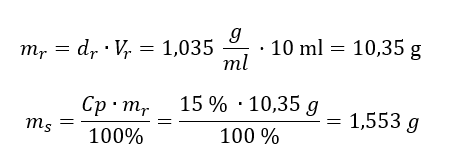
Sposób 2. Wykorzystanie proporcji

Oba sposoby wykazały, że w celu sporządzenia 10ml roztworu o Cp = 15%, o gęstości 1,035 g/ml, należy odważyć 1,553g soli.
Przykład 5. Jakie jest stężenie procentowe roztworu, otrzymanego w wyniku rozpuszczenia 40g substancji w 200ml etanolu o gęstości 0,78 g/ml?
Do obliczenia zadania możemy wykorzystać przekształcenie wzoru na stężenie procentowe. Masę roztworu możemy obliczyć, dodając do siebie masę substancji rozpuszczonej oraz masę rozpuszczalnika. Ze względu na to, że w treści zadania nie jest podana masa rozpuszczalnika, ale jest jego gęstość oraz objętość, to przekształcając wzór na gęstość, możemy obliczyć brakującą daną.
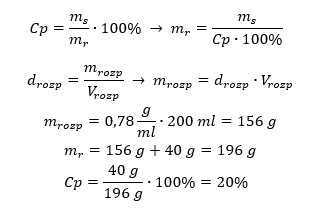
Znajdź swoje miejsce w Grupie PCC. Zapoznaj się z naszą ofertą i rozwijaj się razem z nami.
Program bezpłatnych praktyk letnich dla studentów i absolwentów wszystkich kierunków studiów.